Introduzione
e meccanismi di regolazione epigenetica
Con il termine “epigenetica” si indica un meccanismo adattativo dell’espressione genica in risposta a stimoli ambientali che influenza le attività della cellula [1]. Queste modifiche sono indipendenti dal fenomeno ereditario, ovvero i cambiamenti avvengono anche in cellule che non si dividono come le cellule del sistema nervoso centrale o neuroni.
Ad esempio è stato dimostrato che i meccanismi epigenetici sono coinvolti nella plasticità sinaptica, nell’apprendimento e nella memoria così come in diversi disturbi neuropsichiatrici tra cui la depressione e la tossicodipendenza [2-3-4-5]. Il concetto di stimolo ambientale è direttamente correlato allo stile di vita e ai modelli comportamentali che assume l’individuo quali alimentazione, esercizio fisico, livelli di stress che possono quindi incidere sulla salute degli organi e sulla salute in generale.
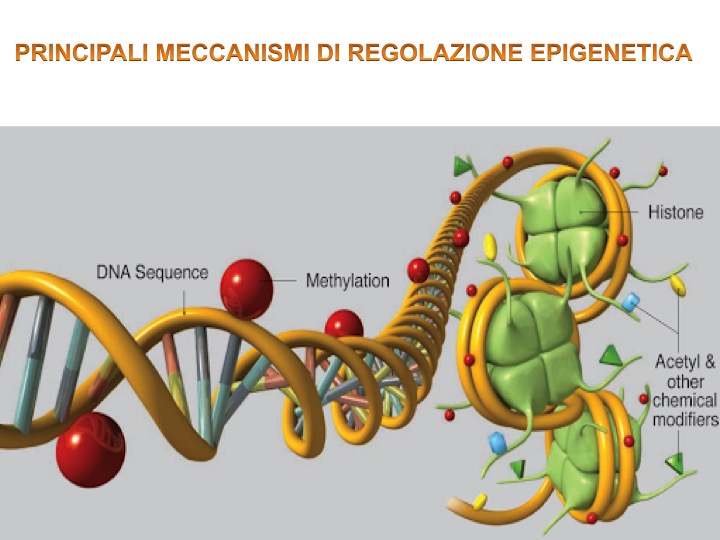
Allo stato attuale sono identificati tre meccanismi di regolazione epigenetica:
- La metilazione del DNA: è il meccanismo più conosciuto che consiste nella trasposizione di un gruppo metile (CH3) in corrispondenza della citosina. La funzione della metilazione è quella di silenziare il gene impedendone l’espressione. Questo meccanismo avviene ad esempio quando la cellula si divide ed è necessario creare un pattern di differenziazione cellulare stabile ed ereditabile. All’interno di questo meccanismo merita considerare che la metilazione può fungere sia come attivatore sia come repressore dell’espressione genica a seconda di dove avviene il meccanismo: infatti se la metilazione avviene a livello del promotore (cioè l’area della sequenza nucleotidica che attiva il DNA) avviene il fenomeno della repressione dell’espressione genica mentre se vengono metilate le isole di citosina che si trovano all’interno del gene allora il gene viene indotto a esprimersi [6]. È interessante quindi notare che lo stesso meccanismo può dare un risultato diverso in base al contesto;
- La marcatura degli istoni: gli istoni hanno un ruolo d’impacchettamento del DNA in modo tale da poterlo conservare in un volume ristretto come il nucleo della cellula. L’istone rappresenta il core proteico del nucleosoma, unità fondamentale della cromatina nel quale si trova il DNA impacchettato. Questi istoni possiedono delle code definite code istoniche che sono soggette a stimoli biochimici (acetilazione, fosforilazione, metilazione, ubiquitinazione) che vanno a regolare l’espressione genica;
- L’azione dei microRNA: sono piccole sequenze di RNA non codificanti che interferiscono con l’azione dell’mRNA (RNA messaggero) impedendo di conseguenza la sintesi proteica.
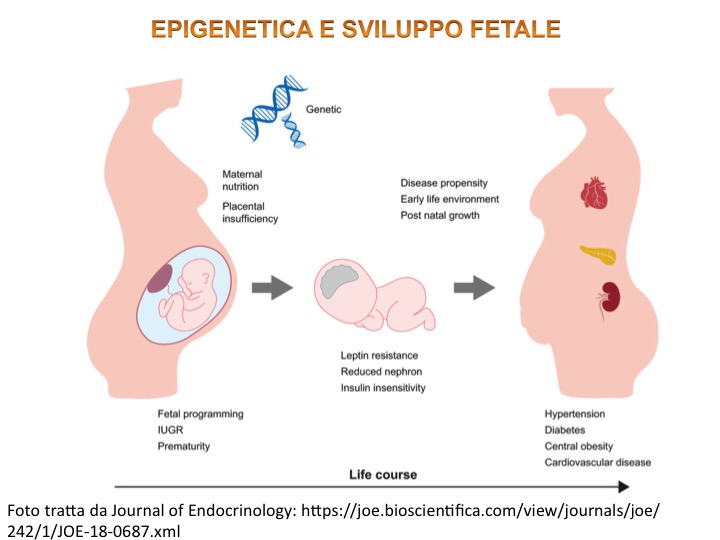
Segnalazione epigenetica e sviluppo fetale sotto stress
I meccanismi epigenetici sono anche implicati durante lo sviluppo in utero e a livello cellulare, quindi, le esposizioni ambientali possono danneggiare il feto compromettendo l’epigenoma dell’organismo in via di sviluppo e predisponendolo ad ammalarsi nel tempo [7]. In merito allo sviluppo embrionale alcuni studi hanno segnalato un aumento fino a 10 volte di rare malattie congenite collegate alle tecniche di riproduzione assistita dove viene alterata la complessa segnalazione epigenetica che avviene nell’ambiente materno nelle prime fasi ontogenetiche [8]. Furono le ricerche di Hans Selye, nella prima metà del 900’, a identificare come l’organismo si adatti costantemente in risposta a stimoli stressanti, definendo lo stesso stress come sindrome generale di adattamento.
Uno studio interessante che avvalora come stress intrauterini possano determinare modifiche anche a lungo termine nell’età adulta è quello di Schultz [9]; uno studio sui figli del cosiddetto “inverno di fame” patito nel 1944 nei Paesi Bassi sotto l’occupazione tedesca dove la popolazione (comprese le donne incinte) fu soggetta ad una forte restrizione calorica giornaliera: circa 400 – 800 calorie al giorno, ben al di sotto quindi della normalità. I risultati furono mostrati per la prima volta nel 1976 ed evidenziarono una serie di conseguenze negative.

Sono interessanti alcune osservazioni in merito a questo studio: coloro che sono stati esposti alla carestia solo durante la tarda gestazione sono nati piccoli e hanno continuato a essere piccoli per tutta la vita, con tassi di obesità più bassi da adulti rispetto ai nati prima e dopo la carestia. Invece, le persone esposte durante la prima gestazione hanno sperimentato tassi elevati di obesità, profili lipidici alterati e malattie cardiovascolari; solo nelle persone esposte alla carestia durante la prima parte della gestazione, c’è una significativa menomazione in un test di attenzione selettiva all’età di 56-59 anni.
In sostanza lo studio mostra come esistano, durante lo sviluppo fetale, delle finestre temporali sensibili dove specifici stimoli ambientali possono incidere da un punto di vista epigenetico sullo sviluppo dell’individuo. In merito a questo studio, fu dimostrato nel 2008, per la prima volta, che i figli della fame olandese, 60 anni dopo, presentavano un deficit nella metilazione del gene che esprime la sintesi di IGF2, fattore insulino simile che regola la crescita del feto [10-11]. Questo a sottolineare come l’imprinting epigenetico possa perdurare nel tempo condizionando la vita adulta.
Il materiale genetico è dunque un elemento dinamico soggetto a variabili indotte da stimoli ambientali; per comprendere meglio questo aspetto sono state studiate coppie di gemelli omozigoti che presentano lo stesso genotipo ma un fenotipo differente ovvero una diversa espressione di quel genotipo. Le coppie gemelle monozigoti divergono man mano che invecchiano. Differenze in modelli epigenetici d’individui geneticamente identici potrebbero essere spiegati dall’influenza di fattori sia esterni che interni. Le abitudini al fumo, l’attività fisica o la dieta, tra le altre, sono fattori esterni che possono avere un’influenza a lungo termine sulle modificazioni epigenetiche [12-13-14]. La segnatura epigenetica è stabile quindi ma anche reversibile.
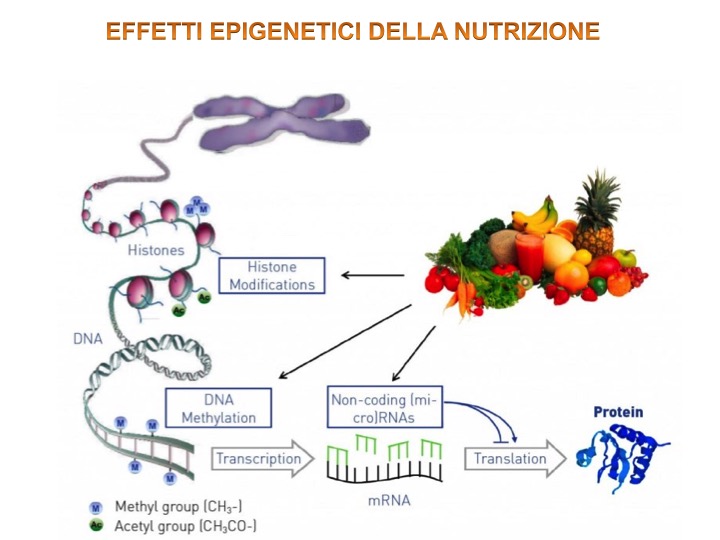
Epigenetica e nutrizione
Ci sono prove sostanziali che la componente alimentare ha un ruolo rilevante nella prevenzione del cancro attraverso meccanismi epigenetici. La letteratura attuale suggerisce fortemente che il consumo di frutta e verdura può influenzare la metilazione del DNA, modificazioni istoniche ed espressione di mRNA nel cancro. Tuttavia, è improbabile che l’effetto protettivo sia a causa di un unico componente alimentare. Pertanto è necessaria.
- L’identificazione di composti e metaboliti rilevanti;
- La capacità dei componenti dietetici bioattivi di raggiungere il tessuto bersaglio in concentrazioni sufficienti per indurre cambiamenti epigenetici desiderabili [15].
Sono state individuate diverse vitamine, minerali e sostanze bioattive che hanno la capacità di proteggere e conservare dal processo d’invecchiamento il telomero che rappresenta la regione terminale del cromosoma. Includono vitamine del gruppo B ed altri elementi ancora come:
- B12 e folati;
- Niacina;
- Vitamina A;
- Vitamina D che contribuisce ad abbassare i livelli di proteina C reattiva, noto marker pro – infiammatorio;
- Vitamine C ed E che contribuiscono a limitare lo stress ossidativo sui telomeri;
- Magnesio, minerale necessario per la replicazione e riparazione del DNA;
- Zinco;
- Ferro;
- Curcuma e acidi grassi omega 3 che possiedono azione antiossidante;
- Polifenoli contenuti ad esempio nei semi d’uva e nel tè verde: anch’essi proteggono il DNA dallo stress ossidativo [16].
In uno studio due gruppi di topolini sono stati sottoposti a differenti tipi di dieta: uno a dieta libera e/o olio di mais mentre l’altro è stato sottoposto a restrizione calorica e/o olio di pesce; quest’ultimo gruppo è vissuto 645 giorni contro i 494 dell’altro, incrementando quindi di oltre il 30% il tempo di vita. Quest’aspetto era associato ad un più basso livello e attività di NF-KB (fattore di trascrizione che svolge un ruolo primario nella regolazione della risposta immunitaria, nell’infiammazione, nella proliferazione cellulare, nell’apoptosi e nel cancro), fattore trascrizionale che regola l’attività di almeno 125 geni, la maggior parte dei quali sono pro-infiammatori [17].
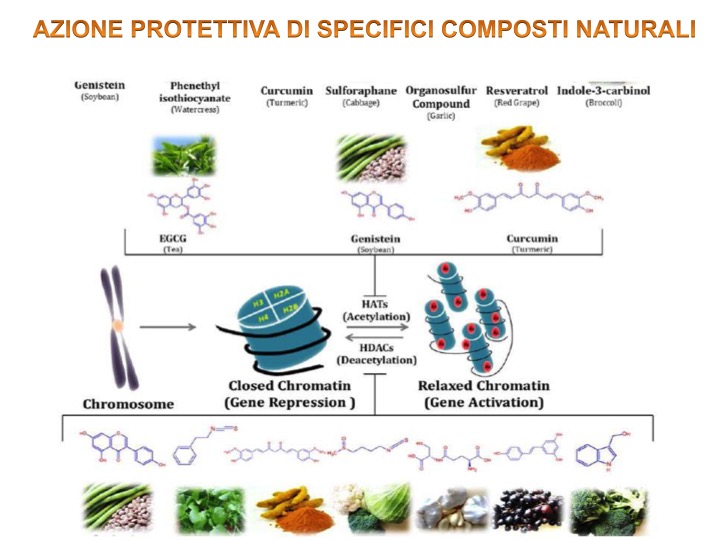
Alcuni composti naturali come l’epigallocatechinagallato (ECGC) presente nel tè verde, la curcumina e il resveratrolo hanno un’azione inibitoria degli enzimi DNMT, una classe di enzimi metilanti implicati nella carcinogenesi mammaria. Quest’aspetto, unito alla mancanza di tossicità, rende questi composti naturali promettenti candidati per la chemioprevenzione del cancro al seno [18].
Epigenetica e esercizio fisico
Sono ormai noti da tempo i benefici dell’esercizio fisico sui parametri neurofisiologici. Meno noti sono gli effetti a livello epigenetico. L’esercizio fisico stimola e coordina l’azione dei geni coinvolti nella plasticità sinaptica con conseguenti effetti sulla conservazione della memoria; ad esempio sono stimolate l’espressione di BDNF (fondamentale fattore neurotrofico), IGF-1 (fattore di crescita che stimola i processi anabolici fra cui quello muscolare) e CREB (fattore di trascrizione cellulare coinvolto nella plasticità neuronale e nella conservazione della memoria) [19]; proprio una diminuzione dell’espressione di CREB è implicata nella malattia di Alzheimer [20].
In uno studio è stata valutata l’espressione del gene ASC che codifica per due citochine ad azione pro – infiammatoria: IL – 1 beta e IL18 [21]. Lo studio è durato 6 mesi e prevedeva un’attività aerobica intervallata: 3 minuti di camminata a bassa intensità al 40% del picco della capacità aerobica alternata ad una camminata ad alta intensità al 70% del picco della capacità aerobica. Sono state osservate le reazioni in tre gruppi: uno di giovani, uno di anziani senza esercizio fisico e uno di anziani con esercizio fisico.
I dati hanno mostrato che i giovani presentavano una metilazione superiore del DNA rispetto agli anziani, aspetto che evidenzia che i processi infiammatori tendono ad aumentare con l’avanzare dell’età; ma assai più importante è stato osservare che il gruppo di anziani che svolgeva esercizio fisico possedeva una metilazione del gene ASC superiore rispetto al gruppo di anziani sedentario. A dimostrazione ulteriore del potente effetto antiinfiammatorio che possiede l’esercizio fisico e di come possano dunque essere suggerite nuove strategie preventive e terapeutiche basate sull’epigenetica attraverso metodi non farmacologici [22].
Lo studio dell’epigenetica mette prepotentemente l’essere umano al centro del processo terapeutico, dove lo stile di vita ha un impatto enorme nello stimolare l’espressione genica e quindi predisporre o meno a determinate malattie.
Riferimenti:
1 Francesco Bottaccioli. Epigenetica e Psiconeuroendocrinoimmunologia, le due facce della Rivoluzione in corso nelle scienze della vita. Edra, 2016.
2 Géranton SM, Morenilla-Palao C, Hunt SP. A Role for Transcriptional Repressor Methyl-CpG-Binding Protein 2 and Plasticity-Related Gene Serum- and Glucocorticoid-Inducible Kinase 1 in the Induction of Inflammatory Pain States. The Journal of Neuroscience. 2007;27(23):6163–6173.
3 Geranton S, et al. Descending serotonergic controls regulate inflammation-induced mechanical sensitivity and methyl-CpG-binding protein 2 phosphorylation in the rat superficial dorsal horn. Molecular Pain. 2008;4(1):35.
4 Kynast KL, et al. Modulation of central nervous system–specific microRNA-124a alters the inflammatory response in the formalin test in mice. PAIN. 2013;154(3):368–376.
5 Viet CT, et al. Re-expression of the methylated EDNRB gene in oral squamous cell carcinoma attenuates cancer-induced pain. PAIN. 2011;152(10):2323–2332.
6 Miho M Suzuki, Adrian Bird. DNA methylation landscapes: provocative insights from epigenomics. Nat Rev Genet. 2008 Jun;9(6):465-76.
7 Céline Tiffon. The Impact of Nutrition and Environmental Epigenetics on Human Health and Disease. Int J Mol Sci. 2018 Nov 1;19(11):3425.
8 Hitoshi Hiura, Hiroaki Okae, Naoko Miyauchi, Fumi Sato, Akiko Sato, Mathew Van De Pette, Rosalind M John, Masayo Kagami, Kunihiko Nakai, Hidenobu Soejima, Tsutomu Ogata, Takahiro Arima. Characterization of DNA methylation errors in patients with imprinting disorders conceived by assisted reproduction technologies. Hum Reprod. 2012 Aug;27(8):2541-8.
9 Laura C Schulz. The Dutch Hunger Winter and the developmental origins of health and disease. Proc Natl Acad Sci U S A. 2010 Sep 28;107(39):16757-8.
10 Bastiaan T Heijmans, Elmar W Tobi, Aryeh D Stein, Hein Putter, Gerard J Blauw, Ezra S Susser, P Eline Slagboom, L H Lumey. Persistent epigenetic differences associated with prenatal exposure to famine in humans. Proc Natl Acad Sci U S A. 2008 Nov 4;105(44):17046-9.
11 Julie St-Pierre, Marie-France Hivert, Patrice Perron, Paul Poirier, Simon-Pierre Guay, Diane Brisson, Luigi Bouchard. IGF2 DNA methylation is a modulator of newborn’s fetal growth and development. Epigenetics. 2012 Oct;7(10):1125-32.
12 Mario F Fraga, Esteban Ballestar, Maria F Paz, Santiago Ropero, Fernando Setien, Maria L Ballestar, Damia Heine-Suñer, Juan C Cigudosa, Miguel Urioste, Javier Benitez, Manuel Boix-Chornet, Abel Sanchez-Aguilera, Charlotte Ling, Emma Carlsson, Pernille Poulsen, Allan Vaag, Zarko Stephan, Tim D Spector, Yue-Zhong Wu, Christoph Plass, Manel Esteller. Epigenetic differences arise during the lifetime of monozygotic twins. Proc Natl Acad Sci U S A. 2005 Jul 26;102(30):10604-9.
13 Rudolf Jaenisch, Adrian Bird. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals. Nat Genet. 2003 Mar;33 Suppl:245-54.
14 Hans T Bjornsson, M Daniele Fallin, Andrew P Feinberg. An integrated epigenetic and genetic approach to common human disease. Trends Genet. 2004 Aug;20(8):350-8.
15 Gordana Supic, Maja Jagodic, Zvonko Magic. Epigenetics: a new link between nutrition and cancer. Nutr Cancer. 2013;65(6):781-92.
16 Ligi Paul. Diet, nutrition and telomere length. J Nutr Biochem. 2011 Oct;22(10):895-901.
17 Shaan E Alam, R B Singh, Siddharth Gupta, Parinita Dherange, Fabien De Meester, Agnieszka Wilczynska, Suniti Dharwadkar, Douglas Wilson, Pali Hungin. Nutritional aspects of epigenetic inheritance. Can J Physiol Pharmacol. 2012 Aug;90(8):989-94.
18 Sameer Mirza, Gayatri Sharma, Rajinder Parshad, Sidhartha Datta Gupta, Pranav Pandya, Ranju Ralhan. Expression of DNA methyltransferases in breast cancer patients and to analyze the effect of natural compounds on DNA methyltransferases and associated proteins. J Breast Cancer. 2013 Mar;16(1):23-31.
19 Jansen Fernandes, Ricardo Mario Arida, Fernando Gomez-Pinilla.
Physical exercise as an epigenetic modulator of brain plasticity and cognition. Neurosci Biobehav Rev. 2017 Sep;80:443-456.
20 Subbiah Pugazhenthi, Maorong Wang, Serena Pham, Chun-I Sze, Christopher B Eckman. Downregulation of CREB expression in Alzheimer’s brain and in Aβ-treated rat hippocampal neurons. Mol Neurodegener. 2011 Aug 19;6:60.
21 K Nakajima, M Takeoka, M Mori, S Hashimoto, A Sakurai, H Nose, K Higuchi, N Itano, M Shiohara, T Oh, S Taniguchi. Exercise effects on methylation of ASC gene. Int J Sports Med. 2010 Sep;31(9):671-5. 22 Steven Horsburgh, Paula Robson-Ansley, Rozanne Adams, Carine Smith. Exercise and inflammation-related epigenetic modifications: focus on DNA methylation. Exerc Immunol Rev. 2015;21:26-41.
22 Steven Horsburgh, Paula Robson-Ansley, Rozanne Adams, Carine Smith. Exercise and inflammation-related epigenetic modifications: focus on DNA methylation. Exerc Immunol Rev. 2015;21:26-41.



