Introduzione
All’interno dell’organismo umano la cellula è avvolta da uno spazio extracellulare composto da una cosiddetta matrice extracellulare (MEC), cioè una rete di sostanze presenti nelle immediate vicinanze della membrana plasmatica cellulare, la quale divide per l’appunto lo spazio intracellulare da quello extracellulare.
Al contrario di quanto si riteneva in passato, la MEC non è una semplice sostanza inerte passiva di sostegno, bensì gioca un ruolo importante nel regolare e determinare la forma e l’attività della cellula [1].È possibile trovare un’abbondante presenza di MEC all’interno dei tessuti connettivi.
Secondo l’anatomia di Gray: “i tessuti connettivi giocano diversi ruoli fondamentali nel corpo, sia strutturali, dal momento che molti degli elementi extracellulari posseggono speciali proprietà meccaniche, sia difensivi, un ruolo che ha una base cellulare. Spesso essi posseggono anche importanti ruoli trofici e morfogenetici nell’organizzare e influenzare la crescita e la differenziazione dei tessuti circostanti” [2].
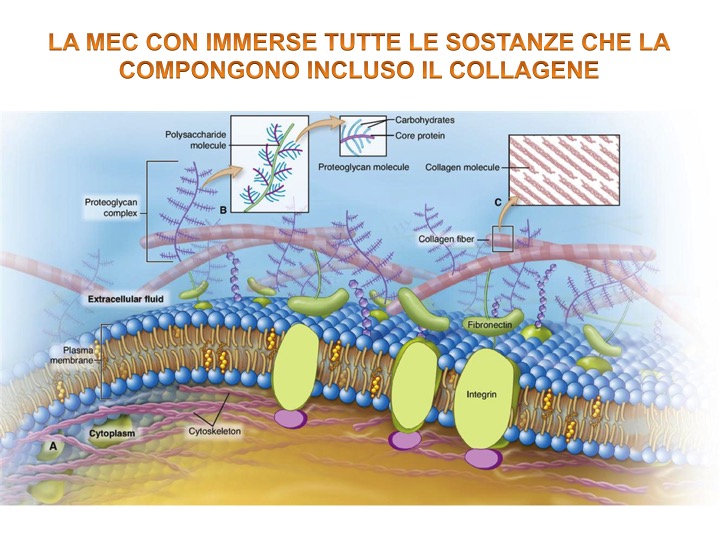
All’interno del tessuto connettivo ci sono tre tipi fondamentali di fibre:
- Reticolina: fibra molto sottile, una specie di collagene immaturo prevalentemente presente nel’embrione e che viene sostituito in gran parte da collagene nell’adulto;
- Elastina: presente in aree come l’orecchio, la cute o specifici legamenti, dove è necessaria elasticità;
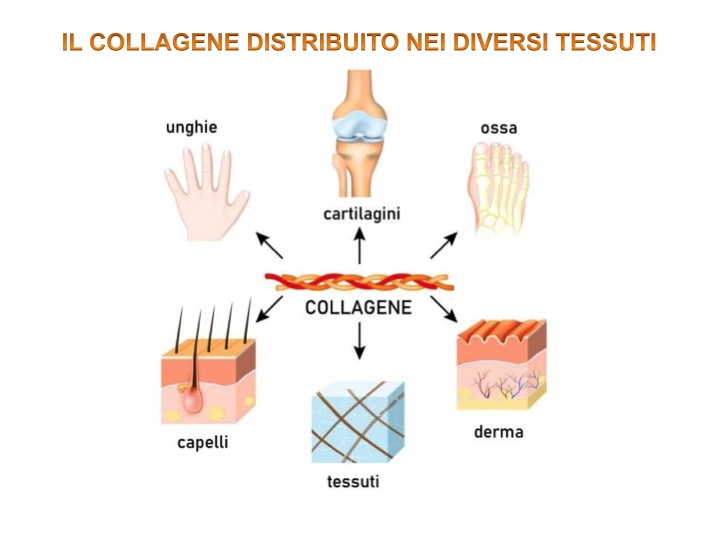
- Collagene: la proteina di gran lunga più presente all’interno del corpo e che predomina all’interno della rete fasciale o connettivale [3].
Struttura e Funzione del Collagene
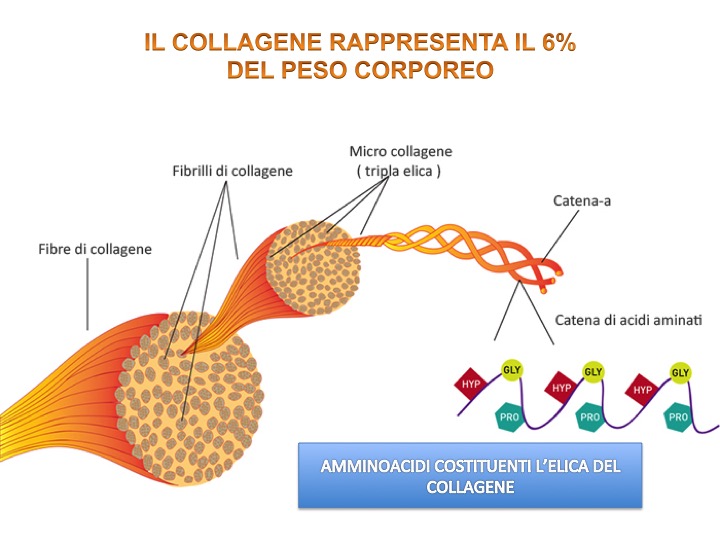
I collageni sono una famiglia di glicoproteine fibrose presenti esclusivamente nelle matrici extracellulari. Sono caratterizzati da un’elevata resistenza alla trazione, cioè a forze di stiramento; questa loro funzione è determinata dalla struttura ad elica che fornisce alte prestazioni in termini di elasticità e resistenza. A tal proposito è stato stimato che una fibra di collagene del diametro di un millimetro sia in grado di mantenere in sospensione un peso di 10 Kg senza rompersi [1]. Il collagene è la proteina più abbondante del corpo umano con circa il 25% delle proteine totali e rappresenta circa il 6% del peso corporeo.
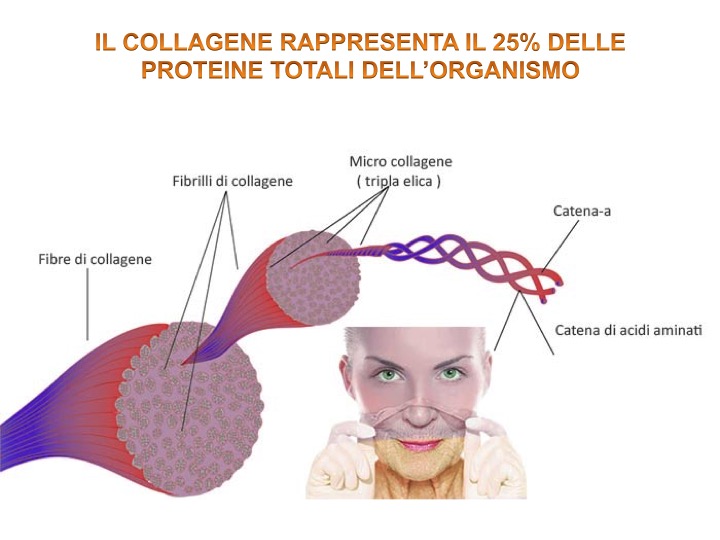
È prodotto principalmente dai fibroblasti, cellule presenti in vari tipi di connettivi ma anche da cellule muscolari lisce ed epiteliali.Esistono molti tipi di collagene: ne sono stati identificati fino a 27, anche se il più comune è quello di tipo 1 (65-80%), soprattutto a livello della componente mio-tendinea [4-5-6].
Elemento interessante è che quando ci sono dei traumi a livello tendineo, ad esempio, avvengono una serie di cambiamenti tra cui quello di un aumento percentuale di altri tipi di collagene modificandone in parte le proprietà di base ed impedendo un ritorno completo alla condizione originaria.
Il ruolo dell’esercizio fisico è senza dubbio fondamentale: per i tendini, l’attività metabolica, le risposte circolatorie e il turnover del collagene si sono dimostrati più pronunciati negli esseri umani di quanto si pensasse fino ad ora. Al contrario, l’inattività riduce notevolmente il turnover del collagene sia nei tendini che nei muscoli. Il carico cronico sotto forma di allenamento fisico porta sia ad un aumento del turnover del collagene sia, a seconda del tipo di collagene in questione, ad un certo grado di sintesi netta del collagene stesso[6].
Nonostante esistano delle differenze fra i diversi tipi di collagene, tutti condividono due importanti caratteristiche:
- Tutte le molecole di collagene sono dei trimeri (prodotto di reazione di tre molecole identiche) formati da tre catene polipeptidiche, chiamate catene α;
- Le tre catene polipeptidiche che formano la molecola di collagene sono avvolte l’una all’altra a formare la caratteristica forma ad elica.
Stile di Vita: Assunzione di Vitamina C, Esercizio Fisico e Fisiologico Processo di Invecchiamento
Le catene α delle molecole di collagene contengono notevoli quantità di prolina e molti dei residui di prolina subiscono un processo enzimatico, definito di idrossilazione, dopo la sintesi della proteina di collagene. Quest’aspetto è di fondamentale importanza perché l’idrossilazione degli amminoacidi di prolina garantisce la stabilità della tripla elica del collagene; viceversa la mancata idrossilazione comporta serie conseguenze sulla struttura e funzione del collagene nei tessuti connettivi.
In questo senso, l’esempio più calzante si manifesta nei sintomi dello scorbuto, malattia derivante dalla carenza di vitamina C (acido ascorbico) che comporta:
- Gengive infiammate e perdita di denti;
- Difficoltosa guarigione delle ferite;
- Ossa fragili;
- Indebolimento della parete dei vasi sanguigni con possibili emorragie interne.
Questo succede perché la vitamina C è necessaria come coenzima nel processo d’idrossilazione.

Il collagene rappresenta, dunque, l’impalcatura insolubile che determina molte delle proprietà meccaniche della matrice e la sua organizzazione spaziale determina il funzionamento del tessuto specifico; ad esempio i tendini che connettono i muscoli alle ossa devono sopportare e resistere ad enormi forze di trazione durante la contrazione muscolare; ed in questo si spiega il motivo del perché le fibre di collagene, all’interno della matrice extracellulare dei tendini, siano disposte in parallelo lungo l’asse del tendine [7].
Oltre ai traumi dove si forma un tessuto cicatriziale che modifica le proprietà tenso-elastiche dei tessuti muscolo-articolari, altri fattori da tenere in considerazione per l’alterazione quantitativa e qualitativa del collagene sono da attribuire al fisiologico processo di invecchiamento che determina:
- Una riduzione del diametro delle fibrille di collagene che ne riduce l’espressione di forza [8];
- Un appiattimento delle fibre, riduzione del numero e delle proiezioni citoplasmatiche [9].
Inoltre, una deformazione non omogenea delle fibre collagene all’interno della componente tendinea o dell’aponeurosi (come ad es. nel muscolo soleo) può condurre ad una compartimentalizzazione del reclutamento muscolare con alterazioni della dinamica della contrazione muscolare [10]. Quindi, il tendine e il muscolo possono andare in tensione ed essere sottoposti a forze non omogenee all’interno dello stesso muscolo e tendine.

Oltre ad un sano stile di vita che prevede innanzitutto esercizio fisico e sana alimentazione, è possibile oggi integrare quelle che possono essere le carenze di collagene o la degenerazione dello stesso.
La Corretta Scelta dell’Integrazione
Tra gli integratori in commercio, Genacol® è leader nella produzione di collagene per la salute delle articolazioni dal 2000. È l’unico prodotto al mondo con matrice di collagene capace di stimolare la produzione di differenti tipi di collagene nell’organismo e tra i pochi integratori alimentari ad avere una documentazione scientifica a supporto di questa portata [11-12-13].
Si tratta di collagene puro al 100% che utilizza una sequenza amminoacidica specifica secondo la Tecnologia Sequenziale AminoLock™. In questo senso nessun altro prodotto al mondo contiene la stessa concentrazione di amminoacidi i quali rappresentano i mattoni delle proteine fra cui il collagene corporeo.
Il collagene AminoLock® ha i peptidi con le dimensioni molecolari più basse al mondo poiché si tratta di collagene idrolizzato, puro al 100%. Proprio in virtù di questa qualità, viene assimilato fino al 98% dall’organismo rendendolo estremamente bioattivo. Ne può trarre importante giovamento la struttura muscolo-articolare ma anche altri importanti tessuti come il derma.
Per saperne di più puoi contattarmi e per approfondire l’argomento e acquistare Genacol® puoi accedere al sito :
Per l’acquisto del prodotto potrai usufruire di uno sconto del 5% attraverso lo specifico codice sconto a te riservato.
Il codice sconto è: corsi2022
Riferimenti:
1 Gerald Karp. Biologia cellulare e molecolare, concetti ed esperimenti. Terza edizione. Edises. 2008.
2 Williams P. Gray’s anatomy, 38th edn. Edinburgh: Churchill Livingstone; 1995:75.
3 Thomas W. Myers. Meridiani miofasciali, percorsi anatomici per i terapisti del corpo e del movimento. Seconda edizione. Tecniche nuove. 2011
4 S Fukuta, M Oyama , K Kavalkovich , FH Fu , C Niyibizi. Identification of types II, IX and X collagens at the insertion site of the bovine achilles tendon. Matrix Biol. 1998 april; 17 (1): 65-73.
5 V Ottani, D Martini, M Franchi, A Ruggeri, M Raspanti. Hierarchical structures in fibrillar collagens. Micron. 2002;33(7-8):587-96.
6 Michael Kjaer. Role of Extracellular Matrix in Adaptation of Tendon and Skeletal Muscle to Mechanical Loading. Physiol Rev. 2004 aprile; 84 (2): 649-98.
7 Marco Franchi, Alessandra Trirè, Marilisa Quaranta, Ester Orsini, Victoria Ottani. Collagen Structure of Tendon Relates to Function. ScientificWorldJournal. 30 mar 2007; 7: 404-20.
8 M R Dressler , D L Butler, R Wenstrup, H A Awad, F Smith, G P Boivin. A potential mechanism for age-related declines in patellar tendon biomechanics. J Orthop Res. 2002 Nov;20(6):1315-22.
9 Strocchi R, De Pasquale V, Guizzardi S, Govoni P, Facchini A, Raspanti M, Girolami M, Giannini S. Human Achilles tendon: morphological and morphometric variations as a function of age. Foot Ankle. 1991 Oct; 12(2):100-4.
10 Ishikawa M, Finni T, Komi PV. Behaviour of vastus lateralis muscle-tendon during high intensity SSC exercises in vivo. Acta Physiol Scand. Jul 2003; 178 (3): 205-13.
11 O Bruyère, B Zegels, L Leonori, V Rabenda, A Janssen, C Bourges, J-Y Reginster. Effect of collagen hydrolysate in articular pain: a 6-month randomized, double-blind, placebo controlled study. Complement Ther Med. 2012 Jun;20(3):124-30.
12 Disponibile su: https://genacol-italia.it/genacol/Etude_Suarez_publie%CC%81.pdf Ultimo accesso 21/02/2021.
13 Disponibile su: https://genacol-italia.it/genacol/Etude_PARM.pdf Ultimo accesso 21/02/2021.